De Um Exemplo De Reação Quimica Cuja Velocidade Do Fenomeno nos transporta para o fascinante mundo da cinética química. Exploraremos, de forma detalhada, como a velocidade de uma reação química é influenciada por diversos fatores, desde a concentração dos reagentes até a presença de catalisadores. A compreensão desses mecanismos é crucial em diversas áreas, impactando desde processos industriais até reações biológicas vitais.
Através de um exemplo prático, analisaremos a cinética de uma reação específica, desvendando seus segredos e revelando a complexa dança molecular que define sua velocidade.
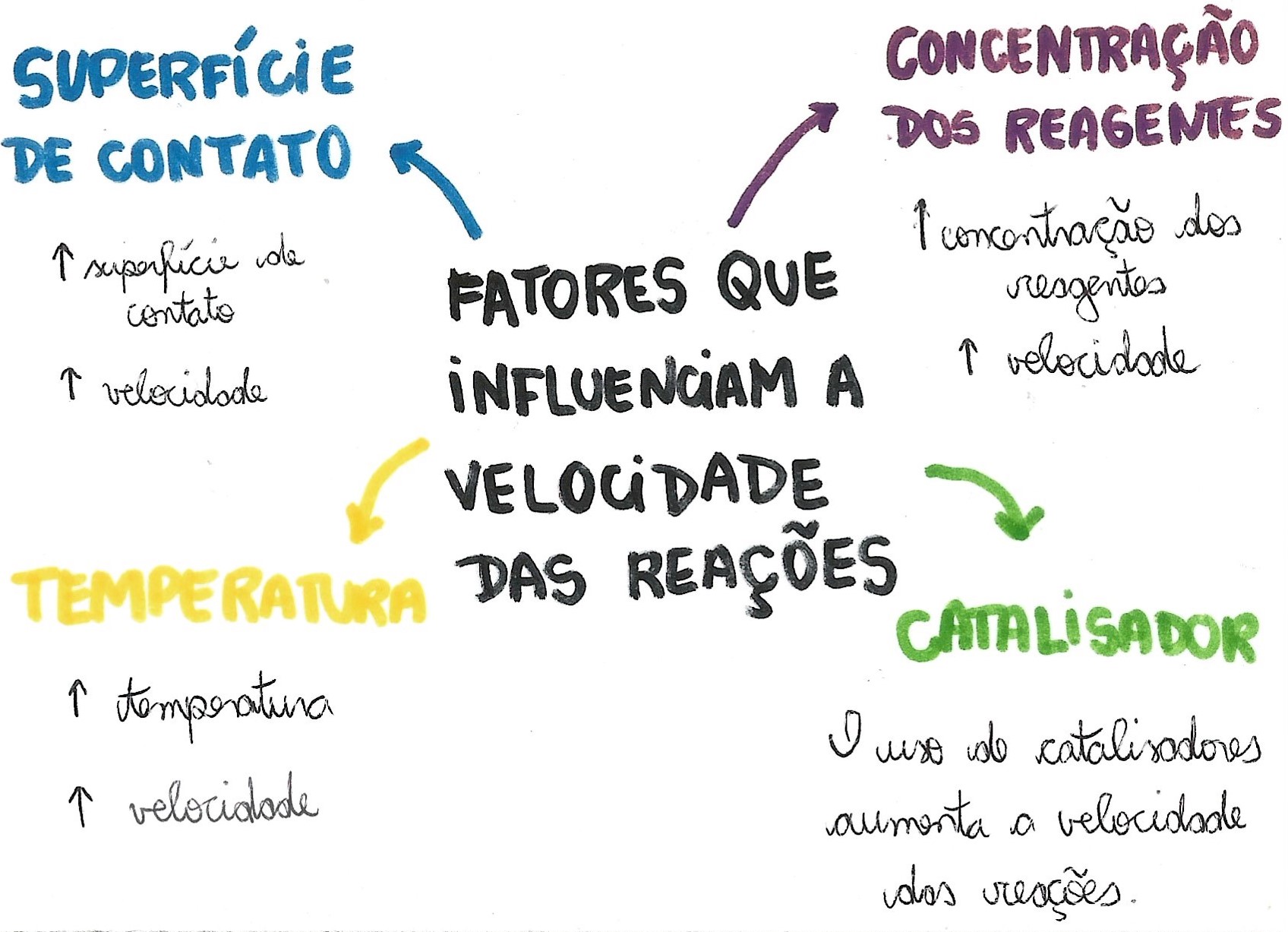
A investigação da velocidade de reações químicas permite-nos otimizar processos industriais, prever o impacto ambiental de reações químicas e compreender mecanismos biológicos fundamentais. A observação cuidadosa dos fatores cinéticos – concentração, temperatura, presença de catalisadores e superfície de contato – revela a intrincada relação entre a estrutura molecular dos reagentes e a rapidez com que eles se transformam em produtos.
Através de métodos experimentais, podemos quantificar a velocidade da reação e modelar matematicamente sua dependência em relação aos fatores cinéticos, abrindo caminho para previsões precisas e controle eficaz dos processos químicos.
A Dança Molecular: Uma Jornada pela Velocidade das Reações Químicas: De Um Exemplo De Reação Quimica Cuja Velocidade Do Fenomeno

A dança das moléculas, um balé invisível aos nossos olhos, rege o universo químico. A velocidade com que essas partículas se encontram e reagem, um processo intrincado e fascinante, define a própria essência das transformações químicas. Compreender a velocidade de uma reação química não é apenas uma curiosidade científica; é a chave para dominar processos industriais, prever impactos ambientais e desvendar os segredos da vida.
Este artigo mergulha nesse mundo microscópico, explorando os fatores que influenciam a velocidade das reações e desvendando os mecanismos que regem essa coreografia molecular.
Velocidade de Reação Química: Um Conceito Fundamental, De Um Exemplo De Reação Quimica Cuja Velocidade Do Fenomeno
A velocidade de uma reação química é medida pela variação da concentração de reagentes ou produtos em um determinado intervalo de tempo. Imagine um rio caudaloso: quanto mais rápido a água flui, maior a velocidade. Analogamente, uma reação química “rápida” apresenta uma grande variação de concentração em um curto período, enquanto uma reação “lenta” exibe uma variação gradual. Diversos fatores orquestram essa velocidade: a concentração dos reagentes (maior concentração, maior chance de colisões efetivas), a temperatura (maior temperatura, maior energia cinética, mais colisões), a presença de catalisadores (substâncias que aceleram a reação sem serem consumidas), e a superfície de contato (maior superfície, maior área para interação entre reagentes).
A compreensão da velocidade das reações é crucial em diversos contextos. Na indústria, o controle da velocidade permite otimizar processos de produção; no meio ambiente, a previsão da velocidade de reações de degradação de poluentes é essencial para mitigar impactos; e em sistemas biológicos, a velocidade das reações enzimáticas é fundamental para a manutenção da vida. A combustão de um palito de fósforo representa uma reação extremamente rápida, enquanto a formação de rochas sedimentares ilustra um processo químico que ocorre em escalas de tempo geológicas, extremamente lento.
Reação de Decomposição do Peróxido de Hidrogênio: Um Estudo de Caso
A decomposição do peróxido de hidrogênio (H₂O₂) em água (H₂O) e oxigênio (O₂) é um exemplo clássico de reação cuja velocidade é facilmente mensurável. Esta reação, representada por 2H₂O₂(aq) → 2H₂O(l) + O₂(g), é relativamente lenta em condições ambientes, mas pode ser acelerada pela presença de um catalisador, como o dióxido de manganês (MnO₂).
| Fator | Efeito na Velocidade | Explicação | Exemplo Numérico (hipotético) |
|---|---|---|---|
| Concentração de H₂O₂ | Aumenta a velocidade | Maior concentração implica em maior número de colisões entre moléculas de H₂O₂, aumentando a probabilidade de reação. | Dobrando a concentração, a velocidade dobra (reação de primeira ordem em relação ao H₂O₂). |
| Temperatura | Aumenta a velocidade | Aumento da temperatura aumenta a energia cinética das moléculas, levando a colisões mais energéticas e efetivas. | Um aumento de 10°C pode dobrar ou triplicar a velocidade (dependendo da energia de ativação). |
| Presença de MnO₂ | Aumenta drasticamente a velocidade | O MnO₂ atua como catalisador, fornecendo um caminho alternativo de reação com menor energia de ativação. | A velocidade pode aumentar em várias ordens de grandeza. |
| Superfície de contato (se H₂O₂ sólido fosse usado) | Aumenta a velocidade | Maior superfície de contato aumenta a área disponível para colisões entre reagentes. | Um pó reage mais rápido que um bloco sólido. |
Métodos para Determinar a Velocidade da Reação
Vários métodos experimentais permitem determinar a velocidade de uma reação química. A escolha do método depende da natureza da reação e dos reagentes envolvidos. A titulação, por exemplo, é adequada para reações que envolvem a produção ou consumo de íons H⁺ ou OH⁻. Métodos espectrofotométricos medem a absorção ou transmissão de luz, permitindo monitorar a concentração de espécies coloridas.
Métodos manométricos medem a variação de pressão em um sistema fechado, úteis para reações que produzem ou consomem gases. Neste caso, utilizaremos um método espectrofotométrico, que monitora a formação de oxigênio através da variação da absorção de luz.
- Preparação da solução de H₂O₂.
- Adição de catalisador (MnO₂).
- Monitoramento da absorção de luz em intervalos de tempo regulares utilizando um espectrofotômetro.
- Construção de um gráfico da absorbancia em função do tempo.
- Cálculo da velocidade da reação a partir da inclinação da curva (velocidade = ΔAbsorbância/ΔTempo).
O Papel dos Catalisadores: Aceleração da Dança Molecular
Catalisadores são substâncias mágicas que aceleram as reações químicas sem serem consumidas no processo. Seu mecanismo de ação envolve a diminuição da energia de ativação, a barreira energética que os reagentes precisam superar para se transformar em produtos. Imagine uma montanha que os reagentes precisam escalar para se transformar em produtos. O catalisador cria um túnel, um caminho alternativo com menor elevação, facilitando a transformação.
Na indústria, catalisadores são essenciais em inúmeros processos, como a síntese de amônia (processo Haber-Bosch) e a conversão de hidrocarbonetos em combustíveis. Na reação de decomposição do H₂O₂, o MnO₂ atua como catalisador, aumentando drasticamente a velocidade da reação. Sem o catalisador, a reação é lenta; com o catalisador, a reação é muito mais rápida. A diferença observada é significativa, resultante da redução da energia de ativação.
O perfil energético da reação com catalisador apresenta um pico menor (energia de ativação menor) em comparação com a reação sem catalisador. A diferença entre os dois picos representa a redução da energia de ativação proporcionada pelo catalisador.
Lei da Velocidade e Ordem de Reação
A lei da velocidade descreve matematicamente a relação entre a velocidade da reação e as concentrações dos reagentes. Para a decomposição do H₂O₂, supondo dados experimentais hipotéticos, podemos determinar a lei da velocidade e a ordem da reação em relação a cada reagente. Por exemplo, se a duplicação da concentração de H₂O₂ dobrar a velocidade da reação, a reação é de primeira ordem em relação ao H₂O₂.
A equação de Arrhenius relaciona a constante de velocidade da reação com a temperatura e a energia de ativação, fornecendo uma compreensão mais profunda da dependência da velocidade com a temperatura.

