Alosterismo: Uma Visão Geral
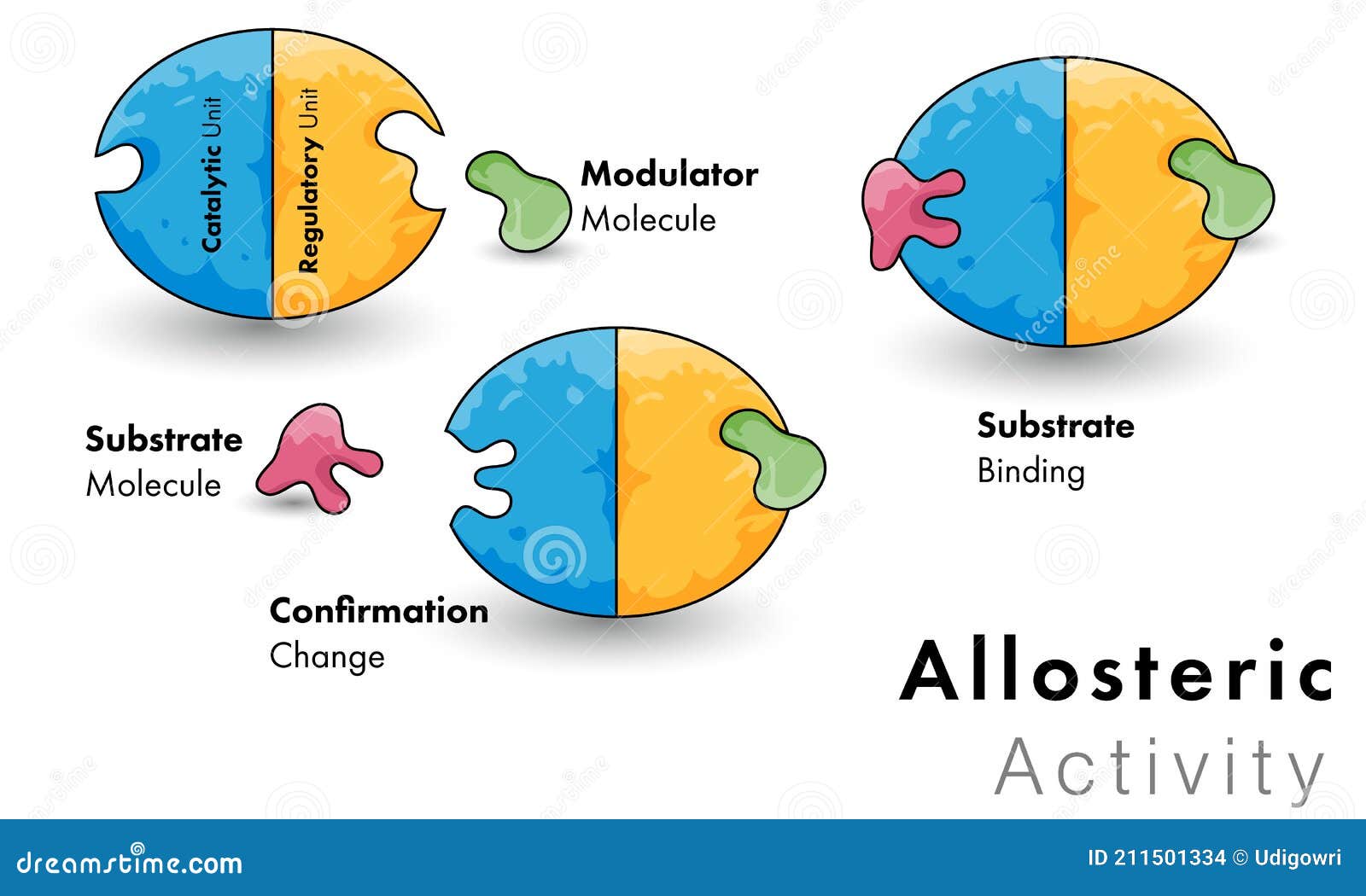
Descreva O Conceito De Alosterismo Usando A Hemoglobina Como Exemplo – O alosterismo é um mecanismo fundamental na regulação da atividade enzimática e de outras proteínas. Ele se caracteriza pela capacidade de uma proteína, chamada proteína alostérica, de mudar sua conformação e, consequentemente, sua atividade em resposta à ligação de uma molécula, chamada efetor alostérico, em um sítio diferente do sítio ativo, denominado sítio alostérico. Essa mudança conformacional pode aumentar (regulação alostérica positiva) ou diminuir (regulação alostérica negativa) a afinidade da proteína pelo seu ligante.
A importância do alosterismo reside na sua capacidade de modular a atividade de proteínas-chave em vias metabólicas, permitindo uma resposta rápida e eficiente a mudanças nas condições celulares.
Regulação Alostérica Positiva e Negativa
A regulação alostérica positiva ocorre quando a ligação de um efetor alostérico aumenta a afinidade da proteína pelo seu ligante. Imagine um interruptor que facilita a ligação; isso é análogo à regulação positiva. Já a regulação alostérica negativa acontece quando a ligação de um efetor alostérico diminui a afinidade da proteína pelo seu ligante. É como um interruptor que dificulta a ligação, diminuindo a atividade da proteína.
Importância do Alosterismo em Vias Metabólicas
O alosterismo desempenha um papel crucial na regulação de vias metabólicas, permitindo que as células respondam a mudanças nas concentrações de metabólitos e adaptem seu metabolismo às necessidades celulares. Por exemplo, um produto final de uma via metabólica pode agir como um efetor alostérico negativo sobre uma enzima inicial da mesma via, inibindo sua atividade e regulando a produção do produto final.
Este tipo de mecanismo de feedback negativo é essencial para a homeostase celular.
A Hemoglobina: Um Exemplo Clássico de Proteína Alostérica
A hemoglobina, a proteína responsável pelo transporte de oxigênio no sangue, é um exemplo notável de proteína alostérica. Sua estrutura quaternária, composta por quatro subunidades (duas subunidades α e duas subunidades β), cada uma ligando uma molécula de heme contendo um íon ferro, permite a interação entre as subunidades, resultando em comportamento cooperativo na ligação do oxigênio.
Subunidades da Hemoglobina e suas Propriedades Estruturais
Cada subunidade da hemoglobina apresenta uma estrutura terciária globular, com o grupo heme encaixado em uma bolsa hidrofóbica. A interação entre as subunidades é crucial para o alosterismo da hemoglobina. As mudanças conformacionais em uma subunidade influenciam a conformação das outras, resultando em cooperatividade na ligação do oxigênio.
Afinidade da Hemoglobina pelo Oxigênio
A hemoglobina apresenta diferentes afinidades pelo oxigênio dependendo do seu estado de oxigenação. A oxihemoglobina (hemoglobina ligada ao oxigênio) tem maior afinidade pelo oxigênio do que a desoxihemoglobina (hemoglobina sem oxigênio). Esta diferença de afinidade é essencial para o transporte eficiente de oxigênio dos pulmões para os tecidos.
Modelo Concertado e Sequencial de Alosterismo na Hemoglobina
Dois modelos principais descrevem o alosterismo na hemoglobina: o modelo concertado (ou simétrico) e o modelo sequencial (ou assimétrico). No modelo concertado, a hemoglobina existe em dois estados conformacionais principais: um estado de alta afinidade (R) e um estado de baixa afinidade (T). A ligação do oxigênio a uma subunidade desloca o equilíbrio para o estado R, aumentando a afinidade das outras subunidades.
Já no modelo sequencial, a ligação do oxigênio induz mudanças conformacionais graduais nas subunidades, sem a necessidade de uma transição completa entre os estados R e T.
Efeito do 2,3-Bisfosfoglicerato (2,3-BPG) na Hemoglobina
O 2,3-BPG é um efetor alostérico negativo que reduz a afinidade da hemoglobina pelo oxigênio. Sua ligação estabiliza a conformação T da hemoglobina, dificultando a ligação do oxigênio. Este efeito é crucial para a liberação eficiente de oxigênio nos tecidos.
Sítio de Ligação do 2,3-BPG e seu Mecanismo de Ação
O 2,3-BPG se liga a uma cavidade central na desoxihemoglobina, entre as subunidades β. Essa ligação estabiliza a conformação de baixa afinidade (T), dificultando a ligação do oxigênio e facilitando sua liberação nos tecidos.
Curva de Dissociação do Oxigênio com e sem 2,3-BPG
A presença de 2,3-BPG desloca a curva de dissociação do oxigênio para a direita, indicando uma menor afinidade da hemoglobina pelo oxigênio. Isso facilita a liberação de oxigênio nos tecidos, onde a pressão parcial de oxigênio é baixa.
| Pressão Parcial de O2 (mmHg) | Saturação de O2 (%)
|
Saturação de O2 (%)
|
Diferença (%) |
|---|---|---|---|
| 20 | 30 | 20 | 10 |
| 40 | 60 | 40 | 20 |
| 60 | 80 | 60 | 20 |
| 80 | 90 | 75 | 15 |
Efeito do pH e da PCO2 na Hemoglobina (Efeito Bohr)
O efeito Bohr descreve a influência do pH e da pressão parcial de dióxido de carbono (PCO 2) na afinidade da hemoglobina pelo oxigênio. Um pH mais baixo (mais ácido) e uma PCO 2 mais alta diminuem a afinidade da hemoglobina pelo oxigênio, facilitando sua liberação nos tecidos.
Mecanismo do Efeito Bohr
A diminuição do pH e o aumento da PCO 2 promovem a protonação de resíduos de histidina na hemoglobina, levando a mudanças conformacionais que estabilizam o estado T e reduzem a afinidade pelo oxigênio. O CO 2 também pode se ligar diretamente à hemoglobina, contribuindo para a redução da afinidade pelo oxigênio.
Fatores que Influenciam a Afinidade da Hemoglobina pelo Oxigênio
- Pressão parcial de oxigênio (PO 2)
- Pressão parcial de dióxido de carbono (PCO 2)
- pH sanguíneo
- Concentração de 2,3-BPG
- Temperatura
Implicações Fisiológicas do Alosterismo na Hemoglobina: Descreva O Conceito De Alosterismo Usando A Hemoglobina Como Exemplo
O alosterismo na hemoglobina é fundamental para o transporte eficiente de oxigênio dos pulmões para os tecidos. A cooperatividade na ligação do oxigênio permite que a hemoglobina se ligue ao oxigênio com alta afinidade nos pulmões, onde a PO 2 é alta, e libere o oxigênio com baixa afinidade nos tecidos, onde a PO 2 é baixa.
Cooperatividade na Ligação do Oxigênio e sua Otimização
A ligação do oxigênio a uma subunidade da hemoglobina aumenta a afinidade das outras subunidades pelo oxigênio, um fenômeno chamado cooperatividade. Isso garante que a hemoglobina seja eficientemente saturada com oxigênio nos pulmões e que libere a maior parte do oxigênio nos tecidos onde a demanda é maior. Este processo é crucial para atender às necessidades metabólicas dos tecidos.
Comparação entre o Transporte de Oxigênio pela Mioglobina e Hemoglobina, Descreva O Conceito De Alosterismo Usando A Hemoglobina Como Exemplo

A mioglobina, proteína muscular que armazena oxigênio, apresenta uma curva de dissociação do oxigênio hiperbólica, ao contrário da curva sigmoidal da hemoglobina. A alta afinidade da mioglobina pelo oxigênio permite que ela ligue e armazene oxigênio eficientemente, enquanto a hemoglobina, com sua curva sigmoidal e comportamento alostérico, é ideal para o transporte de oxigênio entre os pulmões e os tecidos.
Em resumo, o alosterismo, demonstrado exemplarmente pela hemoglobina, é um mecanismo de regulação crucial para a vida. A capacidade da hemoglobina de ajustar sua afinidade pelo oxigênio em resposta a mudanças no ambiente – seja o pH, a pressão parcial de CO2 ou a concentração de 2,3-BPG – é fundamental para o transporte eficiente de oxigênio dos pulmões para os tecidos.
Compreender esse processo bioquímico complexo nos permite apreciar a intrincada maquinaria da vida e a elegância de sua regulação. A pesquisa contínua nessa área promete desvendar ainda mais detalhes sobre esse fascinante processo, abrindo caminho para avanços em medicina e biotecnologia. A interação delicada entre estrutura, função e ambiente destaca a importância do estudo do alosterismo, um processo que impacta diretamente a nossa saúde e bem-estar.

